SKLADOVÁNÍ VODÍKU VE FORMĚ HYDRIDŮ
Skladování vodíku ve formě kovových hydridů
Systém tohoto uskladnění je založen na principu vázání vodíku do materiálu na bázi kovů při vhodných teplotách a tlacích. Reakce plynného vodíku s kovem se nazývá absorpční proces. Vodík je absorbován přímo do objemu materiálu. U jednoduchých krystalických hydridů kovů dochází k začlenění atomárního vodíku přímo do intersticiálních míst ve struktuře krystalografické mřížky. Vázání vodíku je exotermická reakce a při plnění zásobníku se uvolňuje teplo, proto je třeba náplň chladit. Při opačném postupu, tedy uvolňování vodíku z materiálu je třeba teplo dodat. Vodík se poté z materiálu uvolňuje v plynné formě. Proces lze mnohokrát opakovat bez ztráty skladovací kapacity. Sledovanými parametry u těchto systémů jsou především teplota, při které dochází k uvolnění vodíku z materiálu, hmotnostní a objemová kapacita absorbátoru, cena a složitost systému. Kovové hydridy měly potenciál prosadit se v mobilních aplikacích, jako reverzibilní uložení vodíku, přímo v dopravním prostředku, kde by uvolnění vodíku z materiálu proběhlo za nízké teploty a tlaku. Optimální provozní podmínky pro palivový článek s polymerní membránou jsou od 1 – 10 atm a teplotě 25 – 120 °C. Podmínky vychází z využití odpadového tepla palivového článku. Jednoduchý kovový hydrid jako např. LaNi5H6 funguje za těchto podmínek. Jeho nevýhodou ovšem je nízká gravimetrická kapacita (podíl kapacity článku na jeho hmotnost) uložení vodíku (cca. 1,3hm %) a příliš vysoké náklady pro mobilní aplikace.
Dalšími materiály pro uložení jsou tzv. aktivované prášky bohaté na hořčík. V laboratorních podmínkách bylo dosaženo gravimetrické kapacity 5 – 6hm % při teplotě 260 – 280 °C. Lepší gravimetrickou kapacitu (např. 18hm % pro LiBH4), než u jednoduchých kovových hydridů poskytují i komplexní hydridy. Jejich nevýhodou je zhoršená reversibilita (uvolňování vodíku).[1]
Skladování vodíku ve formě chemických hydridů
Uskladnění vodíku ve formě chemických hydridů je označení pro ostatní hydridy, které v sobě (až na výjimky) neobsahují kov. Jde především o sloučeniny bóru a dusíku. Vodík je generován z materiálu pomocí chemické reakce. Často se jedná o reakce mezi hydridy a vodou nebo alkoholy. Reakce jsou hůře reversibilní, než u kovových hydridů, a proto je jejich použití přímo ve vozidle složitější. Vyhořelé palivo a vedlejší produkty jsou vyjímány a následně regenerují mimo vozidlo.
Hydrolýza. Reakce mezi chemickými hydridy a vodou za vzniku vodíku. Do této kategorie spadá např. NaBH4.
NaBH4 + H2O ⟶ NaBO2 + 4H2
Aby byla s palivem možná manipulace a nedošlo k reakci např. při čerpání paliva do dopravního prostředku, jsou hydridy před vlhkostí chráněny pomocí suspenze v stabilizované kapalině. Ve chvíli, kdy je třeba uvolnit vodík, suspenze je smíchána s vodou a dojde k produkci vodíku ve velmi čisté formě. Gravimetrická kapacita je asi 4hm %.
Dalším materiálem pro hydrolýzu, který je zkoumán, je MgH2. Jeho gravimetrická kapacita v laboratorních podmínkách dosahovala až 11hm %.
MgH2 + H2O ⟶ Mg(OH)2 + H2[2]
Hydrogenace / dehydrogenace
Hydrogenace je chemická reakce, jejíž podstatou je přidání molekuly vodíku do sloučeniny. Opačným procesem je dehydrogenace, při které dochází naopak k uvolnění vodíku ze sloučeniny. Tyto reakce jsou po mnoho let studovány jako možnost skladování vodíku. Reakce při přeměně decalinu (C10H18) na naftalen (C10H8) může uvolnit 7,3hm % vodíku při teplotě 210 °C. Výhodou této metody je, že pro reakci není třeba přítomnost vody.
C10H18 ⟶ C10H8 + 5H2
Nové výzkumy se zaměřují na reakci mezi hydridy lehkých kovů s metanolem a etanolem. Metoda by měla poskytovat řízenou produkci vodíku při pokojové teplotě. Nevýhodou je, stejně jako u reakcí s vodou, složitý proces regenerace. Pro mobilní aplikace je další nevýhodou nutnost potřeby alkoholu při reakci, který zvyšuje hmotnost a náklady na celý systém.
Skladování vodíku pomocí sorpce
Výzkum uložení vodíku pomocí sorpce, je důležitým tématem vědecké komunity několika posledních let. Sorpce funguje na principu hromadění látky (adsorbátu) na povrchu pevné látky (adsorbentu). Adsorbční kapacita materiálu roste s jeho povrchem. Známé, jsou dva druhy. Prvním je fyzikální adsorpce, která využívá přitažlivých sil. Druhým způsobem je chemická sorpce, která využívá chemických vazeb.
Uhlíkové nanotrubice
Nové experimenty ukazují, že kapacita uložení vodíku v uhlíkových nanotrubicích (anglicky carbon nanotubes, dále jen CNT), při pokojové teplotě a tlaku 8 MPa nepřekoná hodnotu 0,42hm %. Svazek CNT ukládají velké množství vodíku, ale pouze za kryogenních podmínek. Experimentální a teoretické studie ukázaly, že tento jev způsobuje malá interakce mezi H2 a CNT, při pokojové teplotě.[3]
Nanotrubice nitridu bóru Dalším materiálem pro uložení vodíku jsou nanotrubice nitridu bóru (anglicky boron nitride nanotubes, dále jen BNNTs). Jedná se o materiál na bázi uhlíku, do kterého byly importovány heteroatomy. Tím bylo dosaženo vyšší interakce nanatrubic s H2, než je tomu u CNT. Experimenty ukazují, že je možné uložit až 2,6hm % vodíku při pokojové teplotě. Další pokusy ukázaly, že pokud by se BNNTs zhroutila struktura, bylo by možné při pokojové teplotě, uložit až 4,2hm % vodíku.
Pillared graphen
Materiály na bázi uhlíku mají velký potenciál, uplatnit se v komerčních aplikacích. Jedna z věcí, která brzdí jejich využití, je nutnost zvětšení skladovací kapacity. Je třeba zvýšit množství adsorbovaných molekul vodíku. Je prokázáno, že adsorpce závisí na pórovitosti materiálu. Z těchto důvodů byl navržen tzv. pillared graphen. Jedná se o kombinaci dvou forem uhlíku. Skládá se z paralelních vrstev grafenu, na které jsou vertikálně umístěny uhlíkové trubice. Tento materiál poskytuje možnost změny jeho pórovitosti. Malé póry mají za následek zhoršení ukládání molekul vodíku nebo úplně znemožní jejich uložení. Na druhou stranu, velké póry mají za následek prázdný prostor v materiálu. Pouze s ideální velikostí pórů můžeme dosáhnout optimální skladovací kapacity. Pórovitost lze měnit pomocí různých délek a průměrů trubic, spolu se změnou vzdáleností mezi trubicemi.[4]
Shrnutí alternativních technologií
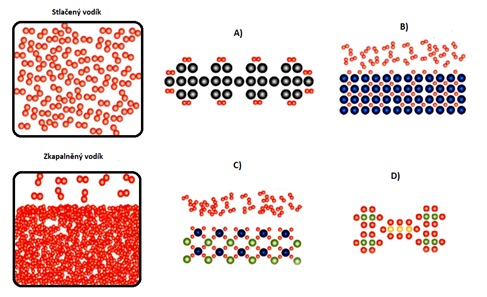
V předchozí kapitole byly zmíněny hlavní alternativní technologie uskladnění vodíku. Celkově je spousta jiných metod ve vývoji, experimentuje se se všemi sloučeninami nesoucí vodík od uhlovodíků až po amoniak a stále se zdokonalují již známe metody. Následující obr. 9 znázorňuje principy, jak fungují jednotlivé konvenční a alternativní metody.Obrázky v prvním sloupci znázorňují stlačený a zkapalněný vodík. Obrázek A znázorňuje princip uchovávání vodíku na povrchu pevných látek adsorpcí, kdy je vodík vázán ve vodíkových molekulách H2 nebo může být vázán pouze po atomech H. Obrázek B představuje absorpci vodíkových atomů, které jsou vtaženy do mřížek materiálů (tato metoda umožňuje uchování většího množství vodíku v menších objemech za nízkých tlaků a téměř pokojových teplot. Obrázky C a D
znázorňují složité hydridy, kde je vodík pevně vázán v jejich molekulových strukturách v podobě chemických sloučenin obsahujících vodík. Hustota se zvyšuje od A po D.[1]
|
Obrázek 8: Princip funkcí různých metod uskladnění vodíku |
[1] Wikimedia Commons. [online]. Dostupné z: https://commons.wikimedia.org/s/index.php?search= hydrogenace&title=Special:Media+Search&go=Go&type=image
[1] EUROPEAN COMMISSION, Directorate General. Hydrogen storage: state-of-theart and future perspective [online]. Luxembourg: Office for Official Publications of the European Communities, 2003. ISBN 92-894-6950-1.
Dostupné z: http://publications.jrc.ec.europa.eu/repository/bitstream/111111111/6013/1/EUR%2020995% 20EN.pdf
[2] ENERGY.GOV: OFFICE OF ENERGY EFFICIENCY & RENEWABLE ENERGY [online]. Dostupné z: http://energy.gov/eere/fuelcells/fuel-celltechnologies-office
[3] FROUDAKIS, George E. Hydrogen storage in nanotubes & nanostructures. Materialstoday[online]. 2011, vol. 14, issues 7-8. Dostupné z: http://www.sciencedirect.com/science/article/pii/S1369702111701626
[4] DIMITRAKAKIS, Georgios K., Emmanuel TYLIANAKIS a George E. FROUDAKIS. Pillared Graphene: A New 3-D Network Nanostructure for Enhanced Hydrogen Storage. Nano Letters [online]. 2008-10-08, vol. 8, issue 10, s. 3166-3170. DOI: 10.1021/nl801417w. Dostupné z: http://pubs.acs.org/doi/abs/10.1021/nl801417w
[1] Fuel cell technologies program [online]. Zveřejněno: Leden 2011. Dostupné z: http://www1.eere.energy.gov/ hydrogenandfuelcells/ pdfs/fct_h2_storage.pdf