M5 Výroba vodíku a bezpečnost
Kursthemen
-
-
Přes svůj obrovský potenciál pro průmysl i energetiku byl vodík dlouho na okraji pozornosti energetiky. Jeho nevýhodou je, že ho v přírodě téměř nenajdeme v čisté a využitelné podobě. Vodík je totiž velmi reaktivní plyn a vyskytuje se převážně ve sloučeninách. Pro masivnější využití se získává například z vody nebo metanu.
Jeho přednosti jsou ale značné, a proto je jeho využití v posledních letech na vzestupu. Vodík může skvěle sloužit pro skladování energie, a udržet ji bez velkých ztrát po dobu měsíců. To je obrovská výhoda ve srovnání s akumulátory, které elektrickou energii efektivně skladují pouze v rámci dnů.
Pro schopnost konzervovat elektrickou energii se s vodíkem počítá jako se způsobem, kam ukládat energii vyráběnou z obnovitelných zdrojů, jejíž přísun není stabilní.
Předností vodíku je mnoho. Vodík je nejrozšířenějším prvkem ve vesmíru a třetím nejrozšířenějším prvkem na Zemi a je vázán v mnoha sloučeninách. Neomezené množství je ho obsaženo ve vodě, je také základem veškerých organických látek, a především je obsažen ve všech uhlovodíkových palivech, která se používají. Vodík má vysokou hustotu energie (vztaženo na jednotku hmotnosti) a dá se transportovat i skladovat. Při použití vodíku jako paliva je jeho hlavní výhodou čistota spalování. Pokud se vodík použije v motorech s vnitřním spalováním nebo v palivových článcích, vznikne tepelná, mechanická či elektrická energie a neškodný produkt – voda. Nevznikne odpadní CO2 ani další složky, které jsou průvodním jevem při spalování jakékoliv tuhého, kapalného nebo plynného uhlovodíkového paliva. CO2 je hlavní složkou skleníkových plynů a vodíková energetika by především měla omezit jejich tvorbu. Problémem zůstávají oxidy dusíku vznikající ve spalovacím prostoru vodíkového motoru. Jejich množství závisí na přebytku kyslíku, teplotě, tlaku a době zdržení spalin při vysokých teplotách ve spalovacím prostoru. [1]
Barvy vodíku
Vodík se dnes získává různými způsoby a podle toho se rozlišují různé druhy vodíku. K jejich označení se používají barvy.
Hnědý a šedý vodík
Jednou z možností, jak získat vodík je z fosilních paliv jako je uhlí a zemní plyn. Vodíku pocházejícímu z uhlí se říká „hnědý“, vodíku ze zemního plynu „šedý“. Získává se jako druhotný produkt nejrůznějších průmyslových procesů. Nejrozšířenější je tzv. parní reformace, to je zahřívání na vysoké teploty spolu s vodou. Většina dnešní produkce vodíku je šedá. Parní reformace se přitom spoléhá na fosilní paliva a při výrobě vodíku uvolňuje CO2, s její podporou se tedy dlouhodobě nepočítá.
Modrý vodík
Šedý a hnědý vodík lze trochu vylepšit tím, že se produkovaný oxid uhličitý zachytává technologií CCS (Carbon Capture and Storage) a CCU (Carbon Capture and Use). Tím vznikne takzvaný modrý vodík, který pak v celkové bilanci vychází díky odfiltrování emisí lépe, přestože je jeho zdrojem zemní plyn nebo metan.
Růžový vodík
Vyrábí se z jaderné energie a je považován za nízkoemisní. Rovněž se používá označení fialový nebo žlutý. Označení je stále nejednotné.
Zelený vodík
Hlavním cílem vodíkových technologií je ale zbavit se závislosti na fosilních palivech a vyrábět tzv. zelený vodík. Ten vzniká elektrolýzou vody, kdy se rozděluje molekula vodíku od molekuly kyslíku za využití elektřiny. Pokud je energie pro tento proces získaná z obnovitelných zdrojů, je proces považovaný za „zelený“, a vzniká tedy „zelený vodík“.
Vodík má významný potenciál pro dekarbonizaci spotřeby energie. K naplnění tohoto potenciálu je však třeba překonat několik překážek týkajících se skladování, přepravy a distribuce.[1]
[1] Plyn budoucnosti. Jak daleko je Česko na cestě k jeho využití? - Ekolist.cz. Ekolist.cz: životní prostředí, příroda, ekologie, klima, biodiverzita, energetika, krajina, doprava i cestování [online]. Dostupné z: https://ekolist.cz/cz/zpravodajstvi/zpravy/vodik-v-cesku.jak-daleko-jsme-na-ceste-k-vyuziti-plynu-budoucnosti
[1] Získávání vodíku z obnovitelných zdrojů [online]. Dostupné z: https://eu.fme.vutbr.cz/file/Sbornik-EnBio/2006/08%20-%20Brandejska.pdf
-
-
CÍLE:
Po dokončení této kapitoly edukant:
- Vyjmenuje základní vlastnosti vodíku a jeho izotopů;
- rozlišuje mezi barvami vodíku a přirovnává správné barvy vodíku dle způsobu jeho získání;
-
definuje teplotu, při které se vodík stává kapalným.
KLÍČOVÁ SLOVA:
Vodík, barvy vodíku, izotopy vodíku, kritická teplota vodíku
Vodík je nejjednodušší a nejlehčí známý prvek, je 14,38krát lehčí než vzduch a vede teplo 7 krát lépe než vzduch. Je to jeden z hlavních biogenních prvků, společně s uhlíkem, dusíkem, kyslíkem, sírou a fosforem tvoří základní stavební jednotky života na Zemi, díky tomu se vodík vyskytuje ve velké míře v ropě a zemním plynu. Vodík je chemický prvek s protonovým číslem 1 a značkou H. Jedná se o nejrozšířenější prvek ve vesmíru. Na zemi se v čisté formě vyskytuje velmi zřídka, protože snadno difunduje do vesmíru a ochotně tvoří chemické sloučeniny, které se nazývají hydridy. Nejznámější z nich je voda H2O, která se skládá ze dvou atomů vodíku a jednoho atomu kyslíku. [1]
[1] KOTEK, Luboš. Specifika analýzy rizik vodíku. Automa: časopis pro automatizační techniku [online]. Dostupné z: http://www.odbornecasopisy.cz/index.php?id_document=31466
-
SHRNUTÍ KAPITOLY:
- Vodík je nejlehčí chemický prvek s protonovým číslem 1;
- izotopy vodíku se liší dle počtu neutronů v jádru;
- za objevitele vodíku je považován Henry Cavedish.
KONTROLNÍ OTÁZKY:
1) Definuj vodík jako chemický prvek, jeho chemickou značku a protonové číslo.
2) Kolik izotopů má vodík a jak se nazývají?
3) Při jaké teplotě se vodík stává kapalným?
4) V kterém roce objevil Henry Cavedish vodík?
5) Který francouzský chemik pojmenoval vodík?
6) Jakými barvami se označuje vodík, který je získáván z fosilních paliv?
7) Charakterizuj výrobu zeleného vodíku.
-
-
-
CÍLE:
Po dokončení této kapitoly edukant:
- Definuje vodík jako energetický vektor;
- rozlišuje mezi technologií výroby vodíku parním reformováním a parciální oxidací;
- popíše výrobu vodíku z rafinérských plynů;
- vyjmenuje ostatní technologie výroby vodíku z rafinérských plynů.
KLÍČOVÁ SLOVA:
Energetický vektor, parní reformování, parciální oxidace, kryogenní fázová separace, adsorpce, difuze, plasma reforming
Vodík není klasické palivo, ale tzv. energetický vektor neboli nosič energie. Prakticky to znamená, že jej není možné energeticky efektivně a levně těžit. Vodík se totiž na Zemi v elementární formě téměř nevyskytuje, je zde zastoupen ve formě sloučenin. Je tedy třeba jej pracně a s nemalými ztrátami energie vyrábět. Výhodou vodíku oproti fosilním palivům je jeho šetrnost k životnímu prostředí a možnost výroby z obnovitelných zdrojů. To je ovšem negováno faktem, že drtivá většina produkce vodíku je právě z fosilních paliv, za vzniku skleníkových plynů. Mezi nejběžnější výrobní procesy patří parní reformování, parciální oxidace a zplyňování uhlí. Suroviny používané při výrobních procesech jsou uhlí, ropa, zemní plyn a metan. Vedlejšími produkty jsou CO a CO2.
-
SHRNUTÍ KAPITOLY:
- Vodík není klasické palivo ale energetický vektor;
- při výrobě vodíku za pomocí parního reformování reaguje uhlovodíková sloučenina za přítomnosti katalyzátoru s vodní párou;
- při výrobě vodíku metodou parciální oxidace se zplyňují těžké ropné frakce pomocí kyslíku a vodní páry při vysokých teplotách a tlaku;
- vodík je také možno získat z plynů vznikajících z procesů při zpracování ropy;
- další možností získání vodíku je z fosilních paliv.
KONTROLNÍ OTÁZKY:
1) Vysvětli pojem vodík jako energetický vektor.
2) Z jakých látek se získává vodík při parním reformování?
3) Jaké chemické látky vznikají přeměnou látek při parním reformování?
4) Při jakém tlaku a teplotě probíhá výroba vodíku při parciální oxidaci?
5) Je výhodnější pro výrobu vodíku parní reformování nebo parciální oxidace a proč?
6) Jaké tři základní procesy se využívají pro výrobu vodíku z rafinérských plynů?
7) Vyjmenuj další možnosti výroby vodíku z fosilních paliv.
-
-
-
CÍLE:
Po dokončení této kapitoly edukant:
- Definuje princip elektrolýzy vody;
- Popíše rozdíl mezi alkalickou elektrolýzou vody, vysokoteplotní elektrolýzou a termochemickými cykly štěpení vody;
- Vyjmenuje další alternativní technologie výroby vodíku;
- Vysvětlí princip výroby vodíku biotechnologickými procesy.
KLÍČOVÁ SLOVA:
Elektrolýza vody, vysokoteplotní elektrolýza, Westinghouse proces, solární vodíková elektrárna, pee power, biomasa, biofotolýza, fermentace, tmavá fermentace, biofermentace
Obrázek 3: Schéma elektrolýzy vody
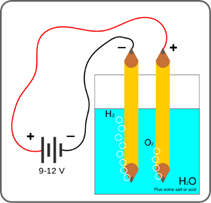
Více než 70 % zemského povrchu zaujímá voda. Vzhledem k hmotnosti je voda složena z 11,2 % z vodíku. Jak už bylo zmíněno dříve, při spalování vodíku se vodík váže zpět na kyslík a vytváří vodu. Považujeme proto vodík za obnovitelný zdroj energie.
-
SHRNUTÍ KAPITOLY:
- Vlivem průchodu stejnosměrného proudu vodným roztokem se štěpí chemická vazba mezi vodíkem a kyslíkem – elektrolýza vody;
- Celková účinnost elektrolýzy se pohybuje v rozmezí 25 – 35 %;
- Elektrolýza je energeticky velmi náročná. Pro výrobu 1 m3 vodíku je potřeba přibližně 5,2 kWh;
- Vzhledem k čistotě procesu je elektrolýzou produkován velice čistý vodíkový plyn;
- Elektrolýza se využívá v oblastech s levnou a „zelenou“ energií;
- Při alkalické elektrolýze se jako elektrolytu využívá kyselina nebo zásada;
- Elektrolýza vody s polymerovým elektrolytem využívá pro přenos iontu membránu;
- Při vysokoteplotní elektrolýze část přiváděné energie tvořená nejen elektrickou energií ale i teplem;
- U termochemického cyklu jsou chemické reakce iniciovány teplem a ostatní chemické látky prochází v cyklu recyklací;
- U fotoelektrolýzy jsou elektrody ponořeny do elektrolytu, ale místo výroby proudu dochází ke štěpení vody na vodík a kyslík;
- Za přispění elektrické energie, vody a oxidu siřičitého vzniká tzv. westinghouse procesem vodík a kyselina sírová;
- Solární panely na mořské hladině mohou být rovněž využity k elektrolýze vody;
- Amoniak a močovina obsažené v moči jsou využívány k výrobě vodíku za pomoci technologie pee power;
- Při spalování nebo zplyňování biomasy může být vzniklá energie využito pro výrobu vodíku např. parním reformováním.
KONTROLNÍ OTÁZKY:
1) Popiš princip elektrolýzy vody.
2) Jaká chemická látka se využívá jako elektrolyt při alkalické elektrolýze vody?
3) Jaká chemická látka se využívá jako elektrolyt při elektrolýze vody s polymerovým elektrolytem?
4) Jaké jsou provozní podmínky teplot při vysokoteplotní elektrolýze?
5) Jaké energie je využíváno při termochemickém cyklu štěpení vody?
6) Co je tzv. westinghouse proces?
7) Kde se nejčastěji využívají solární vodíkové elektrárny?
8) Vysvětli pojem pee power.
9) Vyjmenuj a vysvětli nejznámější technologie výroby vodíku z biomasy.
-
-
-
CÍLE:
Po dokončení této kapitoly edukant:
- Vysvětlí princip palivového článku;
- Rozdělí články podle provozní teploty;
- Definuje články dle typu elektrolytu;
- Vyjmenuje další komponenty automobilu s palivovým článkem
KLÍČOVÁ SLOVA:
Palivový článek, elektrolyt
Existuje několik druhů palivových článků, které se od sebe liší především typem elektrolytu a provozní teplotou. Systémy se liší jednak chemickými reakcemi probíhajícími na jednotlivých elektrodách, provozní teplotou i účinností elektrochemických přeměn. Princip produkování elektřiny je založen na chemické reakci mezi vodíkem a kyslíkem.
Tato reakce má za následek vznik energie a vody. Energie je produkována ve formě
elektrického proudu. Všechny palivové články fungují na stejném principu viz obr. 4. Pokud si vzpomeneme na způsob tvorby vodíku pomocí elektrolýzy vody, zjistíme, že palivový článek funguje podobně. V tomto případě je však vstupní surovinou vodík a výstupní energií elektrický proud. Vodík je pumpován do oblasti anody. Proces rozdělí vodík na jeho ionty a kationty, viz rovnice [12].Obrázek 4: Funkční princip palivového článku

[12] 2H2 ⟶ 4𝐻+ + 4e−
Elektrolyt povolí průchod protonům, ale zabrání toku elektronů od anody ke katodě. Elektrony se ke katodě musí dostat externím oběhem. Proudění elektronů tímto oběhem generuje elektrický proud. Poté se vzduch vžene do oblasti katody, kde se kombinuje s vodíkovými ionty a společně tvoří vodu a teplo, viz rovnice [13].
Celková reakce probíhající v palivovém článku je vyjádřena rovnicí [14].
[14] 2𝐻2+𝑂2 ⟶ 2𝐻2𝑂
Napětí palivového článku je velmi nízké. Uvádí se hodnota okolo 1 V. Pro využití v praxi se musí docílit mnohem vyššího napětí. To je docíleno sériovým zapojením více článků.
-
SHRNUTÍ KAPITOLY:
- Princip produkování elektřiny je založen na chemické reakci mezi vodíkem a kyslíkem;
- Podle provozní teploty dělíme články na: nízkoteplotní, středoteplotní a vysokoteplotní;
- Podle typu elektrolytu se články dělí na alkalické, polymerní, s kyselinou fosforečnou, s roztavenými uhličitany a s tuhými oxidy.
KONTROLNÍ OTÁZKY:
1) Jaká chemická reakce probíhá v palivovém článku?
2) Jaká je hodnota napětí generována palivovým článkem?
3) S jakou teplotou pracují vysokoteplotní palivové články?
4) Jaká chemická látka tvoří elektrolyt alkalických palivových článků?
-
-
-
CÍLE:
Po dokončení této kapitoly edukant:
- Definuje bezpečnostní zásady při manipulaci s vodíkem a jeho biologické účinky;
- Rozlišuje mezi skladováním vodíku v plynném a kapalném skupenství;
- Vysvětlí princip skladování vodíku ve formě hydridů;
- Vysvětlí pojem absorpce a adsorpce.
KLÍČOVÁ SLOVA:
Skladování vodíku, kryogenní nádoby, hydridy, absorpce, adsorpce
Tato kapitola je věnována problematice uskladnění vodíku, která je hlavním omezením jeho rozšíření. Vodík má ze všech paliv nejmenší hustotu a nejnižší bod varu, což značně jeho skladování komplikuje. Hlavní metody uskladňování vodíku budou rozděleny do skupin na již známé a používané konvenční metody a moderní alternativní metody uskladnění.
-
SHRNUTÍ KAPITOLY:
- Vodík tvoří výbušné směsi s kyslíkem, fluorem a chlorem, které jsou velmi snadno zápalné;
- Při rychlé expanzi stlačeného vodíku může dojít k samovolnému vznícení;
- Přímý kontakt s vodíkem způsobuje popáleniny, jeho vdechnutí pak ztrátu vědomí a smrt;
- Skladování vodíku v plynném skupenství je méně energeticky náročné, pro skladování se využívají nádoby o objemu 50 l a tlaku 200 bar;
- Další metodou skladování plynného vodíku je uložení v podzemních uložištích;
- Plynný vodík se dá skladovat také ve skleněných mikrokuličkách;
- Zkapalněný vodík je skladován při teplotě –253 °C;
- Až 30 % energie získané ze zkapalněného vodíku je třeba k jeho zkapalnění;
- Vlivem přestupu tepla z okolí dochází k vypařování LH2, a tím zvyšování tlaku v nádobě;
- Vodík může být absorbován přímo do krystalické mřížky kovových i nekovových materiálů;
- Vodík se může vázat i povrchově na jiné materiály formou adsorpce, a tímto způsobem je možno jej skladovat.
KONTROLNÍ OTÁZKY:
1) S jakými chemickými prvky tvoří vodík výbušnou směs?
2) Popiš, v jakém skupenství se může vodík skladovat.
3) Vysvětli pojem skladování vodíku ve formě hydridů
4) Co je adsorpce?
5) Co je absorpce?
-